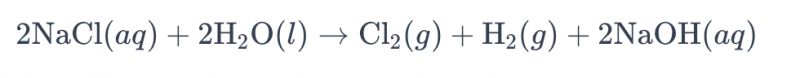Sāls šķīduma elektrolīzes procesu, izmantojot titāna elektrodus hlora ražošanai, parasti sauc par "sāls šķīduma elektrolīzi". Šajā procesā titāna elektrodi tiek izmantoti, lai veicinātu hlorīda jonu oksidācijas reakciju sālsūdenī, kā rezultātā rodas hlora gāze. Kopējais reakcijas ķīmiskais vienādojums ir šāds:
Šajā vienādojumā hlorīda joni oksidējas pie anoda, kā rezultātā rodas hlora gāze, savukārt ūdens molekulas reducējas pie katoda, iegūstot ūdeņraža gāzi. Turklāt hidroksīda joni reducējas pie anoda, veidojot ūdeņraža gāzi un nātrija hidroksīdu.
Titāna elektrodu izvēle ir saistīta ar titāna izcilo izturību pret koroziju un vadītspēju, kas ļauj tam elektrolīzes laikā stabili veikt reakciju bez korozijas. Tas padara titāna elektrodus par ideālu izvēli sālsūdens elektrolīzei.
Sālsūdens elektrolīzei parasti ir nepieciešams ārējs barošanas avots, lai nodrošinātu enerģiju elektrolītiskajai reakcijai. Šis barošanas avots parasti ir līdzstrāvas (DC) barošanas avots, jo elektrolītiskajām reakcijām ir nepieciešams nemainīgs strāvas plūsmas virziens, un līdzstrāvas barošanas avots var nodrošināt nemainīgu strāvas virzienu.
Sālsūdens elektrolīzes procesā hlora gāzes iegūšanai parasti tiek izmantots zemsprieguma līdzstrāvas barošanas avots. Barošanas avota spriegums ir atkarīgs no konkrētiem reakcijas apstākļiem un iekārtas konstrukcijas, bet parasti tas ir no 2 līdz 4 voltiem. Turklāt barošanas avota strāvas stiprums ir izšķirošs parametrs, kas jānosaka, pamatojoties uz reakcijas kameras izmēru un vēlamo ražošanas apjomu.
Rezumējot, barošanas avota izvēle sālsūdens elektrolīzei ir atkarīga no eksperimentu vai rūpniecisko procesu īpašajām prasībām, lai nodrošinātu efektīvu reakciju un vēlamo produktu iegūšanu.
Publicēšanas laiks: 2024. gada 16. janvāris